|
|
|
Faits marquants
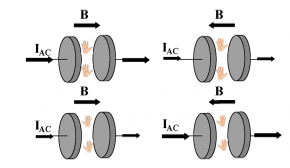
Dielectric magnetochiral anisotropy
Geert L. J. A. Rikken et Narcis Avarvari, Nature Communications juin 2022. DOI : 10.1038/s41467-022-31225-3 Voir l'actualité de l'INC - CNRS info
Erica Benedetti est chargée de recherche au CNRS dans le Laboratoire de Chimie et Biochimie Pharmacologiques et Toxicologiques de l’Université Paris Cité (UMR8601 - CNRS). Elle s’intéresse à la synthèse, la fonctionnalisation et l’étude des propriétés des [2.2]paracyclophanes, petites molécules aromatiques non planes pouvant présenter une chiralité planaire. Ces composés sont utilisés comme briques de base aussi bien pour la conception de nouveaux ligands de l’ARN, que pour le développement de nouveaux catalyseurs et luminophores chiraux. Ces travaux lui ont permis l’obtention de la Médaille de Bronze du CNRS 2022.
"SHIFUMI- SOMO-HOMO Inversion For chiral open-shell pi-conjUgated systeMs" Validation of microscopic magnetochiral dichroism theory M. Atzori, H. D. Ludowieg, Á. Valentín-Pérez, M. Cortijo, I. Breslavetz, K. Paillot, P. Rosa, C. Train, J. Autschbach, E. A. Hillard, G. L. J. A. Rikken1 Publié dans SCIENCE ADVANCES | RESEARCH ARTICLE
https://www.nature.com/articles/s41467-020-18596-1 Abstract Porphyrin cage-compounds are used as biomimetic models and substrate-selective catalysts in supramolecular chemistry. In this work we present the resolution of planar-chiral porphyrin cages and the determination of their absolute configuration by vibrational circular dichroism in combination with density functional theory calculations. The chiral porphyrin-cages form complexes with achiral and chiral viologen-guests and upon binding one of the axial enantiomorphs of the guest is bound selectively, as is indicated by induced-electronic-dichroism-spectra in combination with calculations. This host-guest binding also leads to unusual enhanced vibrational circular dichroism, which is the result of a combination of phenomena, such as rigidification of the host and guest structures, charge transfer, and coupling of specific vibration modes of the host and guest. The results offer insights in how the porphyrin cage-compounds may be used to construct a future molecular Turing machine that can write chiral information onto polymer chains.
https://www.nature.com/articles/s41467-020-19123-y AbstractMolecular motors and switches change conformation under the influence of an external stimulus, e.g. light. They can be incorporated into functional systems, allowing the construction of adaptive materials and switchable catalysts. Here, we present two molecular motor-functionalized porphyrin macrocycles for future photo-switchable catalysis. They display helical, planar and point chirality, and are diastereomers, which differ in the relative orientation of the motor and macrocyclic components. Fluorescence, UV-vis, and 1H NMR experiments reveal that the motor-functionalized macrocycles can bind and thread different variants of viologen guests, including a one-side blocked polymeric one of 30 repeat units. The latter feature indicates that the motor systems can find the open end of a polymer chain, thread on it, and move along the chain to eventually bind at the viologen trap, opening possibilities for catalytic writing on single polymer chains via chemical routes.
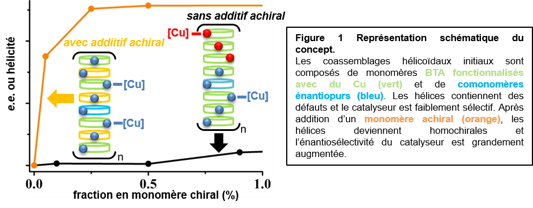
L’amplification de chiralité réfère à la possibilité de contrôler la configuration hélicoïdale de la chaîne principale d’un polymère covalent ou supramoléculaire à l’aide d’un biais chiral relativement faible. Ce biais chiral consiste habituellement en un monomère énantiopur employé en faible quantité ou à un mélange de monomères énantiopurs légèrement biaisé relativement au mélange racémique. Les trialkylbenzene-1,3,5-tricarboxamides (BTA alkyles) et leurs dérivés fonctionnels sont des molécules énormément employées en chimie supramoléculaire de par leur assemblage robuste en hélices dynamiques stabilisées par un réseau de liaisons hydrogène et des interactions aromatiques. L’amplification de chiralité des hélices supramoléculaires à base de motifs de BTA est connue mais a lieu avec une efficacité modérée. Améliorer le degré d’amplification de chiralité dans ces hélices serait bénéfique pour une variété d’applications liées à leur nature chirale. Nous avons découvert que l’addition d’un monomère achiral permet de passer d’hélices supramoléculaires constituées d’un mélange quasi équimolaire de fragments hélicoïdaux droits et gauches, c.-à-d. des hélices quasi racémiques, à des hélices tournant dans le même sens, c.-à-d. des hélices homochirales. Ce phénomène d’émergence d’un assemblage homochiral est particulièrement remarquable car l’addition d’une molécule achirale devait agir comme un diluant de l’information chirale, non comme un exaltant. Dans notre système, des hélices homochirales sont formées qui contiennent seulement 0.5% de monomères chiraux ou un mélange de monomères énantiomères avec un excès énantiomérique (ee) de 10%. L’amplification de chiralité des hélices est améliorée par un ordre de magnitude ce qui est attribué à la stabilisation des coassemblages et la suppression des inversions de sens de rotation (défauts) en présence de l’additif achiral (voir une représentation du concept en Figure 1). Par ailleurs, les atomes de cuivre supportés par ces assemblages hélicoïdaux servent de sites catalytiques pour une réaction d’hydrosilylation, fournissant un alcool hautement enantioenrichi (>90% ee) malgré une charge catalytique en espèce chirale de l’ordre de la ppm. Reference: Yan Li, Ahmad Hammoud, Laurent Bouteiller and Matthieu Raynal, J. Am. Chem Soc., 2020, 142, 5676-5688. https://pubs.acs.org/doi/10.1021/jacs.9b13157
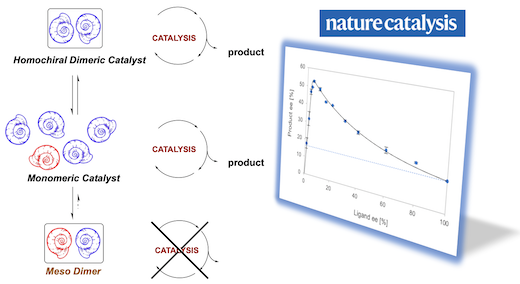
Un système catalytique qui produit des molécules chirales avec une énantiosélectivité plus grande lorsque le catalyseur lui-même est utilisé sous une forme moins énantiopure. L'amplification asymétrique est un phénomène curieux qui jouerait un rôle clé dans l'émergence de l'homochiralité biologique, et donc dans la vie elle-même. En catalyse asymétrique, elle est obtenue via des effets non linéaires positifs, qui permettent de conserver le produit avec un fort excès énantiomérique en présence d’un catalyseur non énantiopur. Lors d’études de ces effets non-linéaires, il a été expérimentalement observé qu’un catalyseur pouvait être plus efficace à générer de la chiralité lorsqu’il n’est pas homochiral lui-même. Il s’agit ici de la validation d’une théorie qui avait été exposée au début des années 90 par le Pr Henri KAGAN et qui a captivée de nombreux chimistes expérimentaux. Une étude mécanistique a été menée et les résultats pointent vers une catalyse à deux composants, où des catalyseurs mononucléaires et agrégés sont en équilibre et en compétition. Ces résultats introduisent une nouvelle classe d'amplification asymétrique en catalyse énantiosélective. Référence : Y. Geiger, A. Maisse-François, T. Achard, S. Bellemin-Laponnaz, Hyperpositive nonlinear effects in asymmetric catalysis Nat Catal (2020). https://doi.org/10.1038/s41929-020-0441-1 |
| Personnes connectées : 23 | Vie privée |

|